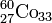المواد الحافظة
ما هي المواد الحافظة:
إنها عبارة عن مواد كيميائية تضاف إلى الأطعمة بهدف المحافظة على سلامتها أو لتحسين لونها أو بنيتها أو مذاقها ، يتكون العديد من هذه المضافات بصورة طبيعية ، ومن ذلك نترات الصوديوم ( وهي مادة تحفظ الأطعمة من الفساد ) ، والزعفران والكركم (مادتان ملونتان) ، والفيتامينات (ج) و(هـ) (مادتان مانعتان للتأكسد) ، ومادة الليسيتين lecithin وهي عامل مستحلب وموازن ، وتتكون مضافات أخرى بصورة طبيعية ، ولكن توجد مواد مصنعة مماثلة لها يمكن استعمالها تجاريا ، نذكر من بينها مادة ريبوفلافين riboflavin ( مادة ملونة ) ، وحمض السوربيك ( مادة تحفظ الأطعمة من الفساد ) ، ومالتول maltol ( مادة لتطييب المذاق ) ، أما سائر المضافات فلا تتكون طبيعيا ، بل تصنع ومنها مادة الطرطرازين tartrazine ( مادة ملونة ) ، وسوربات الكالسيوم ( مادة تحفظ الأطعمة من الفساد ) تضاف كميات قليلة جدا من هذه المواد الكيميائية إلى أطعمة متنوعة ، ويتم فحصها معمليا قبل إضافتها إلى الأطعمة ، ويتقيد منتجو الأطعمة بمستوى سلامة محدد لا يجوز تخطيه .
*اضرار المواد الحافظة :
تقوم هذه المواد إما بتأخير نمو العضويات المجهرية أو منع نموها ، وهكذا تتمكن من إطالة مدة تخزين الأطعمة فتصبح الأطعمة التي تفسد بسرعة متوافرة للمستهلك ، وبثمن غير مرتفع وبذلك يمكن بواسطة هذه المواد الحافظة حفظ الأطعمة واستهلاكها في غير موسمها ، وتقوم بعض هذه المواد الحافظة بأكثر من وظيفة واحدة ، فمثلا : يعتبر ثاني أكسيد الكبريت مادة حافظة ، ومادة مانعة للتأكسد ، وعامل تبيض في آن معا .
*مطيبات المذاق:
هي مواد تعزز مذاق الأطعمة ، فمادة مالتول maltol تستعمل لإعطاء الخبز والكعك رائحة وطعما يوحيان بأنه طازج ، ومادة جلوتامات أحادي الصوديوم monosodium glutamate ، مواد محولة للأطعمة ، تستعمل بشكل واسع كمادة معززة للمذاق ، وتستعمل هذه المواد لتغيير بنية الأطعمة أو تماسكها ، وتشمل العوامل المستحلبة والمركزة وأكثرها مواد طبيعية ، وعوامل تكثيف ولزوجة ، فحامض الألجنيك مادة تستخرج من أعشاب بحرية معينة ولها كل الخصائص المذكورة آنفا ، وتستعمل في صنع البوظة والفطائر المحلاة والمشروبات غير المسكرة ، كما أن مادة اليكتين هي في الوقت نفسه عامل مستحلب وعامل لزوجة .
*ما هو ضرر المضافات:
تخضع المضافات إلى المراقبة الدقيقة والتنظيم الدقيق عند استعمالها ، وليس هناك ما يشير إلى أن أيا من هذه المواد قد تضر بالسكان ككل ، فعندما تظهر الاختبارات التي تجرى على الحيوانات أن مضافا معينا قد يسبب حدوث مرض السرطان ، أو قد يكون ضارا بالصحة بأي شكل ؛ يتم منع استعماله حالا ، غير أن بعض المواد المضافة ، وإن كانت لا تؤدي إلى ضرر معظم الأشخاص ؛ فإنها قد تولد حساسية عند آخرين ، ونذكر على وجه التخصيص مادة الطرطرازين ، وهي مادة شائعة الاستعمال ؛ لإعطاء اللون الأصفر للأطعمة ، ومادة جلوتامات أحادي الصوديوم التي تستعمل كثيرا ؛ لتعزيز مذاق الأطعمة ، وبالأخص الأطعمة الصينية ، فهاتان المادتان تولدان حساسية عند عدد لا بأس به من الأشخاص ، وتشمل أعراض الحساسية لمادة جلوتامات أحادي الصوديوم : الصداع ، وآلام العنق ، وضعف الذراعين ، واضطراب خفقات القلب ( وهي حالة تعرف بعارض المطعم الصيني ) .
*استشر طبيبك:
فإذا شعرت بأنك تصاب بحساسية ناتجة عن أحد المضافات لا تحاول تغيير غذائك الحمائي دون إشراف طبي ، ويجب أن تستشير طبيبك في الأمر ، فقد يقرر إحالتك إلى اختصاصي بأمراض الحساسية ، وسيقوم هذا الاختصاصي بإجراء فحوصات معملية ؛ لتقرير ما إذا كنت مصابا بأعراض الحساسية من جراء مضاف معين ، ولا شك أنه سينصحك بالسلوك الذي يجب أن تتبعه في غذائك الحمائي ،
يوجه اللوم غالبا إلى مضافات الأطعمة كمسببات للنشاط المفرط عند الأطفال ، ولكن معظم الأطباء يعتقدون أنه بالرغم من كون ذلك صحيحا عند عدد قليل جدا من الأطفال ، فإن غالبية الأطفال ذوي النشاط المفرط لا يعانون من حساسية ناتجة عن مضافات الأطعمة

 , وعلى سبيل المثال :
, وعلى سبيل المثال :